1月26日,动物医学学院朱兴全教授团队在国际著名综合性学术期刊《Nature Communications》(2023年影响因子/JCR分区:16.6/Q1,综合性期刊1区 Top),发表了题为“The transcription factor AP2XI-2 is a key negative regulator of Toxoplasma gondii merogony”的研究论文。该研究发现弓形虫转录因子AP2XI-2和AP2XII-1在调控弓形虫有性生殖中发挥关键作用,缺失AP2XI-2和AP2XII-1可诱导弓形虫速殖子向裂殖子的转变。由于裂殖子仅在猫和猫科动物的肠道中生长发育,因此该研究成果提供了一种不依赖感染猫而体外研究弓形虫有性生殖的新策略,也为研发阻断人兽共患弓形虫病传播的防控新手段奠定了基础。
主要研究发现示意图
弓形虫(Toxoplasma gondii)感染人和几乎所有的温血动物,引起人兽共患弓形虫病。弓形虫的生活史涉及两个宿主,经历无性生殖和有性生殖的交替。弓形虫的终末宿主为猫和猫科动物,有性生殖发生在其小肠上皮细胞内,并可在终末宿主的肠外其他组织细胞中进行无性增殖。因此,猫和猫科动物既是弓形虫的终末宿主,也充当中间宿主。在其他动物或人体内,弓形虫仅进行无性增殖,这些宿主被定义为中间宿主。
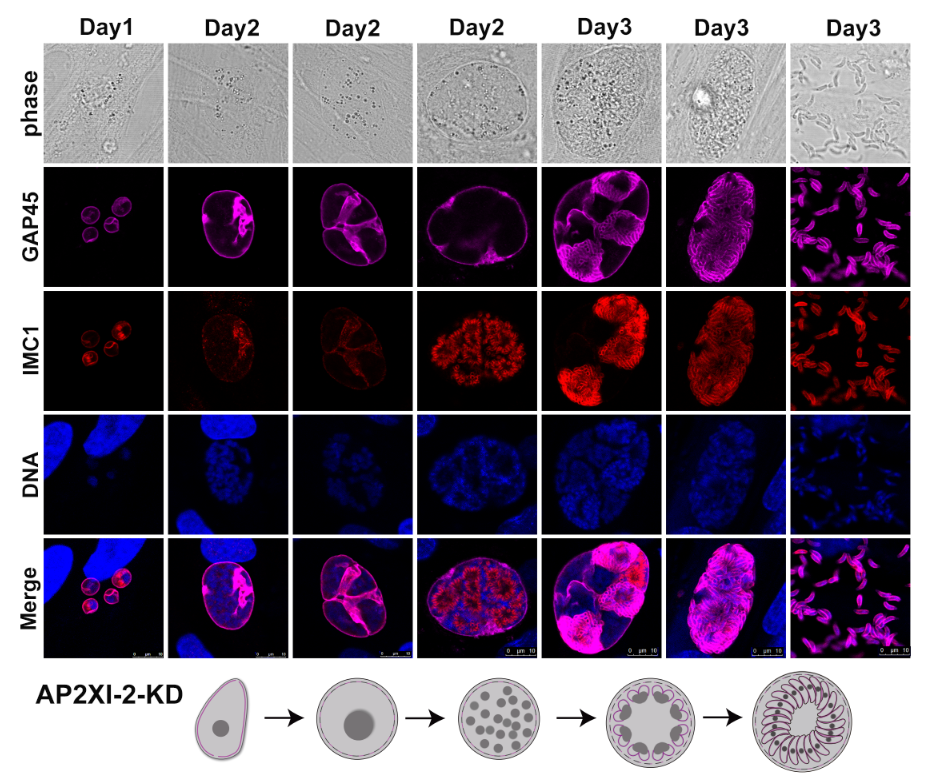
弓形虫的无性生殖包括速殖子和包囊(缓殖子)两种形态。在猫或猫科动物吞食卵囊或包囊后,子孢子或缓殖子会在小肠内逸出并侵入小肠上皮细胞,形成裂殖体。裂殖体成熟后释放裂殖子,继续感染新的肠上皮细胞,形成第二代裂殖体。随着裂殖体的增殖,部分裂殖子发育成雌雄配子体,最终形成卵囊并随粪便排出体外,在适宜的环境条件下发育成具有感染性的成熟卵囊。
该研究发现弓形虫转录因子AP2XI-2和AP2XII-1在速殖子和缓殖子阶段表达,以异二聚体形式结合并募集MORC和HDAC3,靶向裂殖子阶段特异基因启动子,从而抑制裂殖子特异基因的表达。AP2XI-2和AP2XII-1在裂殖子阶段不表达,但激活裂殖子阶段特异基因的表达,进而导致速殖子向裂殖子的转化。
通过建立体外AP2XI-2或AP2XII-1缺失株模型,该研究深入解析了弓形虫裂殖子的增殖机制,并阐释了有性生殖阶段特异表达的其他AP2转录因子的表达方式。过去对弓形虫有性生殖的研究主要限于猫科动物的肠道内,但由于使用猫作为模式生物进行研究可能存在的动物伦理等限制,弓形虫的有性生殖机制尚未完全阐明。该研究建立的AP2XI-2或AP2XII-1缺失株体外模型,为研究弓形虫有性生殖机制提供了新的工具和模型系统,为深入解析弓形虫的有性生殖机制奠定了基础。
该论文第一作者兼共同通讯作者是中国农业科学院兰州兽医研究所“畜禽重要人兽共患病研究创新团队“的王金磊副研究员,他是朱兴全教授2017年毕业的硕博连读生。朱兴全教授是论文主要通讯作者。英国诺丁汉大学兽医学院Hany M. Elsheikha教授是共同通讯作者。
朱兴全教授是我校2020年引进的国家级高层次人才。入职三年多来,他在Clinical Microbiology Reviews、Nature Communications (2篇)、PLOS Pathogens、Journal for ImmunoTherapy of Cancer、Trends in Parasitology、Infectious Diseases of Poverty、npj Biofilms and Microbiomes等国际著名高影响力期刊发表多篇论文,他已连续9年(2014-2022)入选Elsevier(爱思唯尔)“中国高被引学者”榜单。
全文链接:https://doi.org/10.1038/s41467-024-44967-z
 本站首页
本站首页